根據FDA個藥指南及CDE(國家藥品監督管理局藥品審評中心)建議,需進行體外溶出研究、磷酸鹽動力學結合研究和磷酸鹽平衡結合研究,以及體內臨床藥效終點研究,來評價受試制劑和參比制劑生物等效性研究。
截至目前醋酸鈣、碳酸鑭咀嚼片或顆粒、碳酸司維拉姆干混懸劑國內已有多個廠家通過一致性評價,但枸櫞酸鐵片目前國內還未有仿制藥上市。該品種體外磷結合等效性評價的方法是非常關鍵的部分,但該研究具體有哪些挑戰及關鍵注意事項?本文將結合指導原則要求與我司前期經驗進行具體討論與分析。
一、體外磷酸鹽結合等效性評價標準
FDA及CDE頒布的指導原則中,不同磷結合劑的體外等效性評價標準匯總如下:

▍復雜代謝路徑
枸櫞酸鐵在胃腸道中主要通過局部結合磷酸鹽發揮作用,而非系統性吸收,傳統血藥濃度檢測方法難以直接評估其生物等效性。
▍替代指標選擇
需依賴體外磷酸鹽結合能力、鐵釋放速率等替代參數,結合臨床終點(如血磷下降幅度、鐵代謝指標)進行綜合判斷。
▍方法學局限性
體外試驗無法完全模擬人體胃腸環境(如pH波動、食物成分干擾),需通過多批次重復試驗和交叉驗證提高數據可靠性(要求至少n=12)。
▍支持監管申報
FDA和EMA、NMPA均要求提交體外結合試驗數據作為仿制藥開發的必要證據,以證明與原研藥的理化特性一致。
三、實驗設計研究要點
▍磷酸鹽濃度
結合試驗應至少包含8個不同的磷酸鹽濃度,包括達到結合平臺的最高磷酸鹽濃度,約最高磷酸鹽濃度1/10的最低磷酸鹽濃度,以及介于最高和最低之間的其余磷酸鹽濃度。
▍磷酸鹽動力學結合研究測定時間點
每個條件下應在24 h內選擇至少8個時間點。需特別注意達到平臺期前的時間點不能太少,以反映受試制劑和參比制劑動力學變化趨勢。
▍磷酸鹽平衡結合研究濃度和孵育時間
平衡研究磷酸鹽的濃度需結合正常體內每天攝入磷酸鹽量,制劑規格,溶液體積等綜合評定。孵育時間根據動力學達到穩態的時間進行合理選擇。
▍pH監控
對于動力學和平衡試驗都需要提供詳細的pH監控方法、記錄、間隔時間等。
四、實驗設計研究要點
重點參考中國藥典9012《生物樣品定量分析方法驗證指導原則》,需要考察系統適用性、定量限、準確度、精密度、稀釋可靠性、耐用性、殘留、基質效應、膜吸附、穩定性等,以驗證方法準確可靠。
干擾考察:如加入了BES等pH穩定劑來配制磷酸鹽,還需要考察BES對磷酸鹽結合的影響,另外還需要考察輔料、原料藥、空白制劑對磷酸鹽檢測的干擾。
建議進行ISR研究,以考察方法的準確性。
所有資料都需要按照等效性評價相關要求提供,如制劑來源、質檢報告,分析計劃、分析報告、進樣序列表、標曲質控匯總表等。
五、體外磷結合藥動學及平衡研究曲線
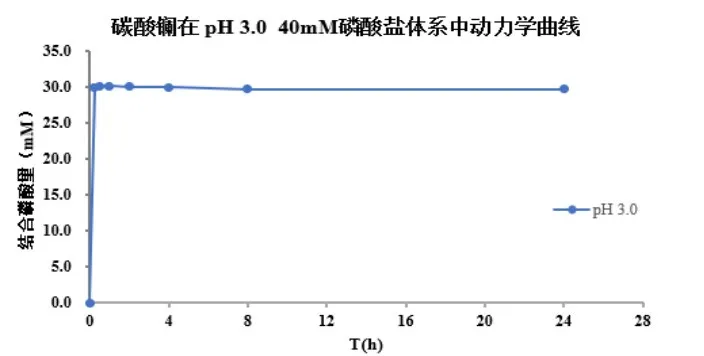
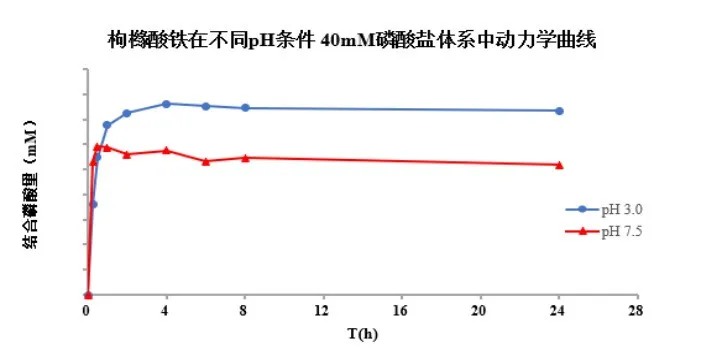
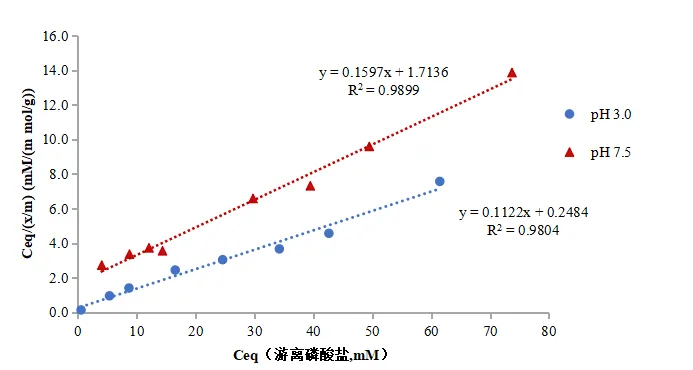
六、體外磷結合研究其他應用
除了抗高磷血癥藥物外,對于可能導致低磷血癥的補鐵劑(如蔗糖鐵、羧基麥芽糖鐵),也可以通過體外磷結果試驗評估藥物與磷酸根的結合能力,從而預測其在體內引起低磷血癥的風險,為臨床用藥提供安全性依據。
湖南科銳斯醫藥的磷酸鹽動力學和磷酸鹽平衡結合研究平臺,已成功開發了碳酸鑭咀嚼片、枸櫞酸鐵片分析方法,并已經助力客戶完成該品種體外磷酸鹽等效性評價研究。

專業團隊:以高級工程師領銜的核心骨干團隊成員56人,本科及以上比例100%,碩士及以上占比41%。
質量體系:取得中國合格評定國家認可委員會(CNAS)實驗室認可證書。實驗過程采用電子化信息系(LIMS)統進行全流程的記錄管理和生物樣本管理,并建立了滿足中美雙報的中英文體系。
特色品種:
外用制劑:洛索洛芬鈉凝膠貼膏、丙酸氟替卡松乳膏等
復方制劑:復方甘草酸苷等
內源性物質:熊去氧膽酸、二十碳五烯酸等
體外磷結合劑:枸櫞酸鐵等


